Los filósofos griegos fueron
los primeros en proponer lo que hoy se conoce como “teoría química”.
Tales de Mileto decidió que
el agua era el elemento base de todas las sustancias, ya que se encuentra en
mayor cantidad.
Estructura
y propiedades de los líquidos. Modelo cinético molecular de los líquidos
De acuerdo al modelo cinético
molecular, las moléculas están en continuo movimiento y entre ellas existe
fuerza de cohesión.
Propiedades
del agua
Es la única sustancia que
presenta los tres estados físicos. El
agua pura es liquida, incolora inodora e insípida, hierve a 100 ºC a nivel del
mar y se congela a una temperatura de 0ºC
Puntos de fusión y ebullición
 Los puntos de congelamiento y
ebullición son la base para medir la temperatura del agua, se utiliza la escala
Celsius
Los puntos de congelamiento y
ebullición son la base para medir la temperatura del agua, se utiliza la escala
Celsius
Densidad
El agua es más densa en su
estado sólido que en su estado líquido es por ello que el hielo flota.
La mayor densidad del agua
alcanza a 4ºC.
Capacidad calorífica
El agua tiene un alto índice
de calor especifico. Calores latentes, de fusión y de evaporación.
Se necesita una caloría para
elevar 1 g de agua en 1 ºC. A esto se le llama calor especifico.
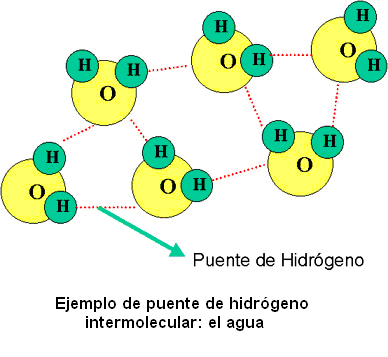
Tensión superficial
El agua tiene una tensión
superficial muy alta, es decir, que es pegajosa y elástica, por ello tiende a
unirse en gotas en lugar de separarse en una capa delgada y fina.
Esta es la responsable de la
acción de la capilaridad, que hace que el agua pueda disolver sustancias.
Poder disolvente
El agua es el mayor
disolvente que hay en la naturaleza. Todas las disoluciones que incluyen al agua
como disolvente se llaman acuosas. Se considera que una sustancia se disuelve
en agua por la interacción entre partículas del soluto y las moléculas polares
del agua.
Abajo podrán encontrar el link de un pequeño documental de habla de las propiedades físicas, químicas y biológicas del agua.
http://youtu.be/U6OwBwcL9A8